让人闻之色变的肿瘤又何尝不是一种人类的进化,烟尘弥漫,污水横流,哪一项不是可引起变异的因素,也许肿瘤正是人类自身为了适应日益恶劣的环境变化而进化的产物。如果把肿瘤看作寄生体的话,那么它并没有动机去杀死寄宿的人类宿主,反而它只不过也想和宿主一起生存繁衍,只不过人类自身还不能承受肿瘤对人类的“爱”,终将被吞噬消亡。

面对肿瘤人类并没有坐以待毙,与肿瘤单“杀”的历史也是一部人类对自身命运的抗争史。现如今人类对于肿瘤的治疗手段从手术、化疗、放疗、靶向治疗已发展到了免疫治疗时代。免疫治疗例如PD-1/PD-L1抗体疗法绝对是当今最热门的治疗手段(没有之一)。
免疫治疗通过诱导、增强或抑制免疫应答来治疗疾病,依靠人体免疫系统杀死肿瘤,例如通过免疫分子(抗体、细胞因子等)、免疫细胞而开发的治疗方案都属于免疫治疗。
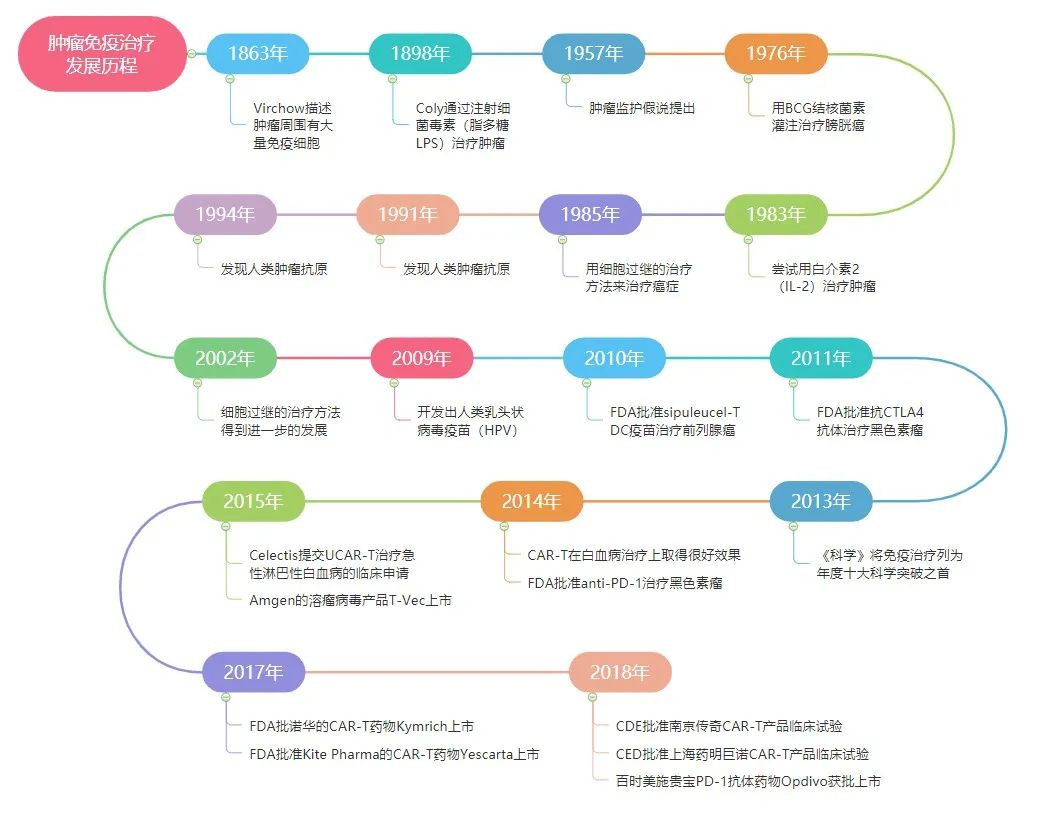
最早的肿瘤免疫治疗可以追溯到1893年,纽约骨科医生William Coley发现骨肉瘤患者在手术切除肿瘤后被化脓性链球菌感染能够导致癌症消退,这是感染促进免疫反应从而治愈癌症的实例,从而创立了“科利毒素”疗法。
1909年Paul Ehrlich提出免疫监视学说,认为免疫系统可以遏制肿瘤的发生,免疫功能异常是肿瘤发生的重要原因之一。
1958年澳大利亚免疫学家Frank Macfarlane Burnet和Lewis Thomas提出了“免疫监视”的假说。
1983年Steven A.Rosenberg成功利用高剂量IL-2治愈了首个晚期黑色素瘤患者。
1992年日本京都大学Tasuku Honjo教授首次发现PD-1,为以后PD-1药物的研发打下了坚实的理论基础。
1999年美国耶鲁大学陈列平教授发现了B7HI,也就是后来的PD-L1,他在随后的2006年开启了第一个PD-1药物的临床试验。
2014年百时美施贵宝的纳武利尤单抗Nivolumab获FDA批准上市,用于治疗黑色素瘤,系全球首款批准上市的PD-1抗体,同年9月默沙东的帕博利珠单抗Pembrolizumab也获批上市。
2016年,FDA批准了首个PD-L1抑制剂罗氏的阿特利珠单抗atezolizumab用于治疗晚期尿路上皮癌。
免疫系统清除肿瘤是一个动态的过程,首先肿瘤形成所产生的新抗原专职的抗原呈递细胞如树突状细胞(DCs,免疫细胞的一种)释放并捕获且进行处理,且DCs启动表达MHC-1和MHC-2(主要组织相容性复合物1和2),将抗原呈递给效应T细胞,从而激活效应T细胞启动对癌症特异性抗原的处理,激活的效应T细胞通过其T细胞受体(TCR)与MHC-1结合的同源抗原相互作用,转运至并浸润到肿瘤床,特异性识别并与癌细胞结合,杀死靶癌细胞。
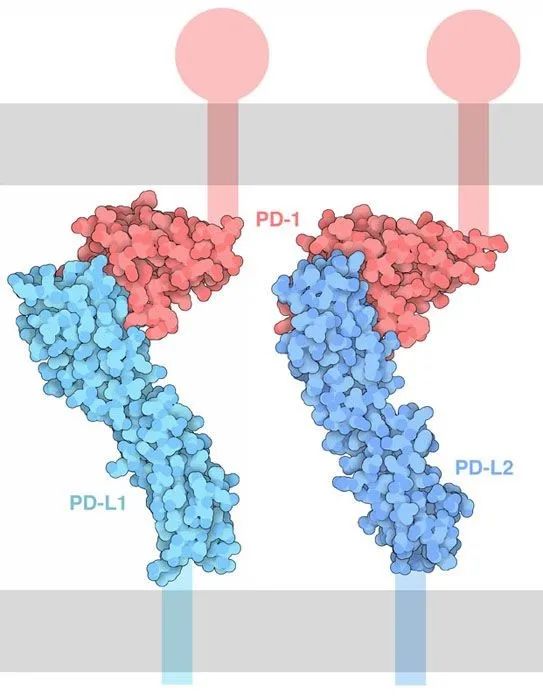
简而言之,免疫系统在排除异己,但肿瘤细胞并没有主动攻击免疫系统,却可以狡猾地通过表达PD-L1来逃避免疫系统的排查。其机制为PD-1是免疫负性调控分子,效应T细胞上的PD-1与肿瘤细胞表面的PD-L1相结合后,可下调T细胞活性,使得肿瘤逃逸免疫系统的识别和杀伤,而抗PD-1/PD-L1抗体可以逆转这一抑制效应。


免疫治疗进军乳腺癌领域的第一块高地就是一块硬骨头——三阴性乳腺癌(ER-,PR-,HER2-)。在乳腺癌所有分型中,TNBC是治疗手段最少,预后最差,恶性都最高的类型。
TNBC常见TP53缺失以及细胞拷贝数突变,存在明显的基因不稳定性,相对其他类型乳腺癌有较强的免疫原性。指南推荐标准治疗策略为早期术前术后采取新辅助及辅助化疗,晚期进展后一线紫杉类,二线卡培他滨,三线艾瑞布林也全是化疗方案。由于缺乏有效的治疗手段,晚期患者5年生存率只有不到30%。
近年来PD-1/PD-L1挑战TNBC的研究史也正是免疫治疗的发展史。
早在2015年Nivolumab即初次尝试,这项Ⅱ期TONIC研究[1]预计纳入84例接受了≤3线解救治疗且疾病进展的TNBC患者,随机分为5组,分别接受2周的诱导治疗,包括:放疗(20Gy)、阿霉素(15mg/w)、口服环磷酰胺(50mg/d)、顺铂(40mg/m2/w)以及空白对照组,随后接受3mg/kg/2w Nivolumab治疗。结果显示总体ORR为20%,阿霉素组为35%,顺铂组为23%。提示短期阿霉素或顺铂可以诱导一个更有利的肿瘤微环境,增强PD-1阻断TNBC的可能性。
Pembrolizumab治疗TNBC的研究就更多了,2016年Ⅰb期KEYNOTE-012研究[2]显示在111名TNBC患者中,其中PD-1阳性率58.6%,常见毒性作用轻微,在27例可评估抗肿瘤活性的患者中ORR为18.5%,中位反应时间为17.9周,中位PFS为1.9个月,中位OS为11.1个月。
另一项Ⅱ期KEYNOTE-086研究[3],Pembrolizumab用于PD-1阳性转移性乳腺癌的一线治疗,显示出显著的疗效和较好的安全耐受性,ORR为23%,中位反应时间为8.4个月,PFS为2.1个月。
Ⅲ期的KEYNOTE-119[4]则纳入既往接受过蒽环类或紫杉类治疗且疾病进展的转移性TNBC患者随机1:1分为两组,分别接受Pembrolizumab或者单药化疗(包括卡培他滨、艾瑞布林、吉西他滨或长春瑞滨),主要终点为OS,次要终点为ORR、DCR、PFS和DOR。其中CPS≥10的PD-L1阳性患者占31%左右,结果显示Pembrolizumab获益随着PD-L1表达的增加而增加。
KEYNOTE-355研究[5]是一项评估Pembrolizumab联合化疗(白蛋白紫杉醇、紫杉醇或吉西他滨/卡培他滨)对比化疗(白蛋白紫杉醇、紫杉醇或吉西他滨/卡培他滨)用于一线治疗既往未经治疗的局部复发性不可手术或转移性TNBC的随机、双盲、Ⅲ期研究的研究,主要终点史PFS和OS。近期ASCO上公布的结果显示,与单独化疗相比,无论是CPS≥10,CPS≥1或ITT人群Pembrolizumab联合化疗均能够显著获得具有统计学及临床意义上的PFS获益。其中CPS≥10人群中获益最大,6个月的PFS为65.0% vs 46.9%,12个月的PFS为39.1% vs 23.0%,HR为0.65。
在2019年ESMO上公布了一项Pembrolizumab联合化疗对比安慰剂联合化疗在早期TNBC中作为新辅助治疗后,再次使用Pembrolizumab对比安慰剂作为辅助治疗的Ⅲ期KEYNOTE-522研究[6],这项研究入组新诊断的T1c N1-2期或T2-4 N0-2期TNBC患者,按照2:1比例随机分为两组,治疗组使用卡铂联合紫杉醇12周后再用多柔/表柔比星联合环磷酰胺12周,同时全程给与Pembrolizumab200mgQ3w,手术之后继续使用Pembrolizumab27周;安慰剂组则全程不应用Pembrolizumab,其余治疗方案一致,主要终点结果显示在铂类新辅助化疗中添加Pembrolizumab,pCR(ypT0/Tis ypN0)提高具有统计学意义和临床意义的13.6个百分点(P=0.00055),高达68.9%,且获益不受PD-L1表达限制。
说完了PD-1再来说说PD-L1在TNBC中的表现,可称之为加速推动TNBC分子分型进程的atezolizumab的Impassion130研究[7]在2018年ESMO重磅公布。
这是一项atezolizumab联合白蛋白紫杉醇对比安慰剂联合白蛋白紫杉醇一线治疗局部晚期或转移性TNBC患者的国际多中心、随机、双盲、Ⅲ期研究,首要联合终点为ITT和PD-L1+人群的PFS和OS,关键次要终点为ORR、DOR和安全性。结果显示atezolizumab联合白蛋白紫杉醇组ITT和PD-L1+人群PFS显著获益(ITT HR=0.80 [95% CI:0.69-0.92];PD-L1+ HR=0.62 [95% CI:0.49-0.78]),在PD-L1+人群中具有临床意义,且耐受性良好。
在2019年ASCO上公布的OS二次分析结果,ITT人群中位OS治疗组与安慰剂组对比为20.0个月比18.7个月,PD-L1+亚组人群则为25.0个月比18.0个月,提示PD-L1 IC状态可以预测atezolizumab联合白蛋白紫杉醇的临床疗效,由于既往TNBC患者中位OS≤18个月,所以此联合方案作为首个跨越2年里程碑OS获益的治疗方案,为PD-L1+mTNBC的一线治疗奠定了新基准。
免疫治疗PD-1和PD-L1疗法已经融入TNBC治疗的各个阶段,从新辅助、辅助到晚期解救治疗,都取得了不俗的成绩,但仍然有些问题需要解决。选择什么样的诊断抗体?什么评分系统?选用哪种细胞类型?肿瘤细胞还是免疫细胞?
这些都是可以影响治疗的预测生物标志物相关问题。例如KEYNOTE-355使用的是22C3检测的CPS定义PD-L1阳性,IMPassion130选用的是SP142检测的IC1%定义PD-L1阳性,基于不同的诊断抗体会带来不同的临床获益,所以亟需头对头的研究进行直接比较。当然对于TNBC免疫治疗还可以同PARPi、CDKi、雄激素受体抑制剂等药物联合使用,包括KEYNOTE-242、IMPassion131、IMPassion132等研究正在进行中,期待结果可以造福广大TNBC患者。
《哈姆雷特》中有句经典台词:生存还是毁灭,这是个值得思考的问题。人类在不断抗击肿瘤的同时,若不关注引起肿瘤的危险因素,终将走向灭亡。自我救赎还是自我毁灭,人类将何去何从…
中国抗癌协会乳腺癌专业委员会常委、中国抗癌协会靶向治疗专业委员会常委、中国老年协会老年肿瘤委员会乳腺癌专业组副主委、天津市抗癌协会临床化疗专业委员会主任委员、天津医学会肿瘤学分会委员;担任《中国肿瘤临床》、《天津医药》、《中华乳腺病杂志》、《中国综合临床》等杂志编委。
Footnote:
IC:肿瘤浸润免疫细胞
TPS:肿瘤细胞阳性比例分数(PD-L1)
CPS:联合阳性分数(肿瘤及周围免疫细胞PD-L1阳性与肿瘤PD-L1阳性细胞比例)是个数值
IPS:免疫细胞阳性比例分数
参考文献:
[1] Voorwerk L, et al. Immune induction strategies in metastatic triple-negative breast cancer[J]. NATURE MEDICINE, 2019 Jun, VOL(25):920-928.
[2] Nanda R, et al. Pembrolizumab in Patients With Advanced Triple-Negative Breast Cancer: Phase Ⅰb KEYNOTE-012 Study[J]. J Clin Oncol, 2016 Jul, VOL(34):2460-2467.
[3] Adams S, et al. Pembrolizumab monotherapy for previously untreated, PD-L1-positive, metastatic triple-negative breast cancer: cohort B of the phase II KEYNOTE-086 study[J]. Annals of Oncology, 2019, 30:405-411.
[4] A Randomized Open-Label Phase III Study of Single Agent Pembrolizumab Versus Single Agent Chemotherapy Per Physician’s Choice for Metastatic Triple Negative Breast Cancer (mTNBC) - (KEYNOTE-119)( https://clinicaltrials.gov/ct2/show/NCT02555657)
[5] Randomized, Double-Blind, Phase III Study of Pembrolizumab (MK-3475) Plus Chemotherapy vs Placebo Plus Chemotherapy for Previously Untreated Locally Recurrent Inoperable or Metastatic Triple Negative Breast Cancer(KEYNOTE-355)( https://clinicaltrials.gov/ct2/show/NCT02819518)
[6] A Phase III, Randomized, Double-blind Study to Evaluate Pembrolizumab Plus Chemotherapy vs Placebo Plus Chemotherapy as Neoadjuvant Therapy and Pembrolizumab vs Placebo as Adjuvant Therapy for Triple Negative Breast Cancer (TNBC)( https://clinicaltrials.gov/ct2/show/NCT03036488)
[7] Schmid P, et al. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer[J]. N Engl J Med, 2018;379:2108-21.
[8] Loibl S, et al. A randomised phase II study investigating durvalumab in addition to an anthracycline taxane-based neoadjuvant therapy in early triple-negative breast cancer: clinical results and biomarker analysis of GeparNuevo study[J]. Annals of Oncology, 2019, 30:1279-1288.
*仅供医学专业人士参考
审批号: CN-59009 有效期:2021-7-9





 京公网安备 11010502033352号
京公网安备 11010502033352号