编者按:随着乳腺癌外科治疗逐渐进入精准时代,“保卫乳房”运动也已经在国内得到重视,但我国的整体保乳率仍较国外有差距。除了保乳术和全切术的生存预后之外,适应症、切缘、新辅助后保乳以及包括年龄、BRCA突变等影响局部复发的因素,都需要在精准、安全的保乳策略中进行探讨。福建省立医院叶松青教授将与我们分享如下。
今年,美国《外科学年鉴》(Ann Surg)发表一篇文章中,总结了2004-2015年40余万例Ⅰ~Ⅱ期乳腺癌患者,其中可匹配的20余万例(保乳和全乳切除各10万余例)。分析显示保乳治疗组与全乳切除组5年总生存期对比(92.9% vs 89.7%,P<0.001),7年总生存期对?(87.7% vs 79.2%,P<0.001),保乳治疗组患者具有更佳的总生存期;亚组分析显示,保乳治疗对Ⅰ期、Ⅱ期乳腺癌均有生存优势(P<0.001)。
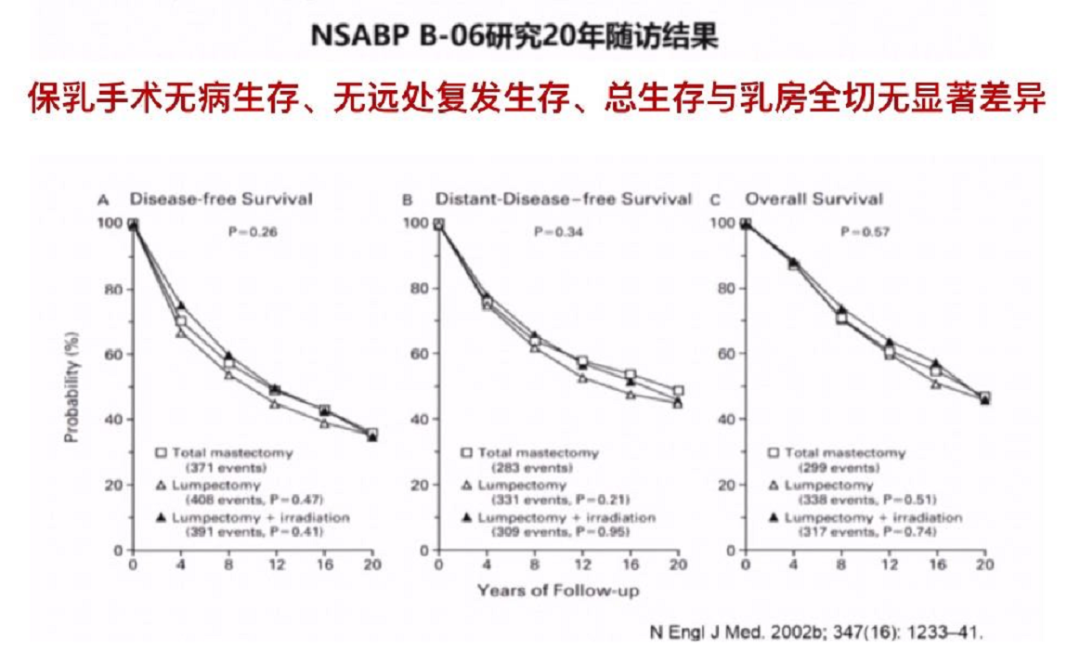
然而,这篇文章带来了一些争议和挑战,比如它的随访时间不到4年,没有年龄的匹配信息,仍需要更长时间的随访和更详尽的数据。在早些年的NSABP B-06研究中,20年随访结果显示,保乳手术在无病生存、无远处复发生存、总生存等方面与乳房全切均无显著差异。一些前瞻性研究包括Milan、NCI、EORTC、DBCCG等生存数据结论与B-06研究一致。目前观点保乳和全切生存结局相似,是否优于全切证据仍然不足。
目前我国总的保乳比例很低(10%~30%),病期相对较晚,乳房相对较小,年轻患者保乳比例相对较高,多中心/多灶性比例低于西方妇女。保乳手术目标在于如何提高保乳率,提高手术成功率,降低复发率。《中国抗癌协会乳腺癌诊治指南和规范(2019版)》明确了保乳手术的适应症和禁忌症,比如多灶性乳腺癌也可进行保乳,同时提出了包括多中心病灶、侵犯乳头(如乳头Paget病)、已知乳腺癌遗传易感性强(如BRCA1/BRCA2突变)等为乳腺癌保乳手术局部复发相关因素,而不再提乳腺癌保乳相对禁忌症,更有益于临床医生实践操作。我们应在保证安全的前提下倾向于放宽保乳的指征,只要满足“有意愿,切干净,有外形,能放疗”4个条件,都可进行保乳。
开展保乳手术应具备相关的技术和设备条件,需要外科、病理科、影像科、放疗科等多学科的密切合作,并需要规范、定期的随访。阴性切缘是保乳手术成功的前提。2014年ASTRO/SSO、2015年St. Gallen指南首次提出,阴性切缘为无浸润性肿瘤或导管原位癌(DCIS)印染;且St. Gallen共识观点不推荐扩大切缘提高局控,不推荐基于肿瘤生物学行为扩大切缘,年轻患者也不推荐扩大切缘。2019年中国抗癌协会指南推荐的阴性切缘定义为:浸润性癌,70%专家认同“No ink on tumor”;原位癌,70%专家认同>2 mm。
关于切缘定义仍存在争议。比如2017年SABCS大会报道一篇meta分析,共纳?38项研究(指南中纳?的两项研究被排除在外,7项新加?)的55302例患者,中位随访7.2年,结果显示:无瘤切缘并?最佳选择,2-5mm宽度可能更安全,但>5mm没有意义,保乳手术需要更安全可行的标准。
保乳标本取材和切缘评估包括肿瘤边缘评估法和腔周边缘评估法,国际指南标准推荐六面切缘墨汁染?法,国内仅1/4单位常规开展,要关注到切缘安全和乳房外形的平衡。中国临床实践中如何获得阴性切缘?术前需对肿物穿刺明确诊断、准确定位,术中适当向外0.5~1.0cm进行肿瘤扩大切除,可以结合术中B超、放射摄片,术中选择性切缘(可疑切缘)快速冰冻。天津肿瘤医院对10501例冰冻诊断报告进行分析,冰冻取材的确诊率为98.6%,假阴性率为1.0%,假阳性率为0.01,保证了冰冻检查的准确性。术前MRI检查较常规检查(钼靶和B超)可多发现10%以上的多中?病灶。
此问题目前尚缺乏统一标准,需个体化处理。一项中国新辅后保乳的现况调查显示,110家三甲医院新辅助后保乳开展率仍然很低,87%的医院新辅后保乳率为20%之内,60%的医院保乳率为10%之内。2018年Lancet Oncol发表的EBCTCG meta分析指出,保乳患者中有/?新辅助化疗,局部复发风险增高(15年绝对?风险增?5.5%),但远处风险、总?生存无差别,所以新辅之后保乳总体安全,需谨慎进?。2017年St. Gallen共识中,82.1%专家支持切除范围倾向于缩小后的肿瘤范围,2019年中国乳腺癌新辅助治疗专家共识则推荐将切缘无肿瘤区域2mm以上定义为病理切缘。
为保证新辅降期后保乳手术安全,需要特别注意新辅后残留肿瘤较大、多灶性及luminal型的患者,密切关注肿瘤病变的退缩模式。研究显示,约50%的luminal型乳腺癌表现为向心性退缩;约80-90%的三阴性及HER2阳性乳腺癌为向心性退缩;当然还有是一些混合型退缩模式,需保证残留钙化灶的完全切除。新辅保乳患者化疗前必须进行标识(外标记,内标记),放置标记夹,以准确定位肿瘤范围。未来希望能够结合病理、影像、分型及异质性建立原发肿瘤退缩预测模型,来指导全身治疗后的乳房手术。
保乳术后局部区域复发?率逐渐降低。2019年Breast Ca Res Treat发表的一荟萃分析,纳入了来自53项Ⅲ期RCT研究的86598例患者,结果显示1991-2019年期间,局部区域复发占所有复发的比率由30%降至15%(P<0.001),局部区域复发比率降低与时间具有相关性,即与全身治疗的不断优化相关。
保乳手术(BCS)后年复发风险特征是持续增高,5年到顶峰,而后逐渐回落。研究显示,影响BCS术后局部无复发生存(LRFS)危险因素包括年轻、高分级、ER-、HER2+等。Ann Surg Oncol一关于多灶保乳的全切转化率与补切率的前瞻性试验ACOSOG Z11102,发现有7%的患者无法成功保乳而直接转为全切,只有67.7%患者一次性手术完成,21.2%患者需二次手术,还有个别患者需三次手术,所以多灶性保乳仍需慎重。
保乳术后复发需了解保乳局部复发模式,有三种复发模式。第一种是真正复发,部位在原发肿瘤周围或疤痕旁或同一象限,往往病理类型是一致的;第二种是同侧第二原发,病变在其他象限或较远位置;第三种是非保乳特有的,胸壁/皮肤的弥漫复发。局部复发位置不同对预后的影响不同,其他部位复发的预后优于真正相同部位的复发。保乳术后复发再次保乳,同侧乳房复发风险>20% ,10年复发风险达31%。
2019 年The Oncologist发表来自SEER大宗数据库的5098患者分析,保乳后局部复发补充性全切对比再次保乳(79.4%全切vs 20.1%继续保乳),全切患者总生存略优于保乳。2020年NCCN指南指出,保乳术后的局部复发,在处理方式上更多建议采用补充全乳切除 。二次保乳仍有部分适合人群包括:单灶、复发灶小(≤2cm)、无复发间期长(>4年)、ER阳性。当然需考虑再次保乳同侧乳房局部复发风险,二次放疗的可行性、美容效果、患者的心理及经济压?等;还必须完善各项检查,排除远处转移,综合考虑患者意愿和全身情况制定合适的治疗措施。

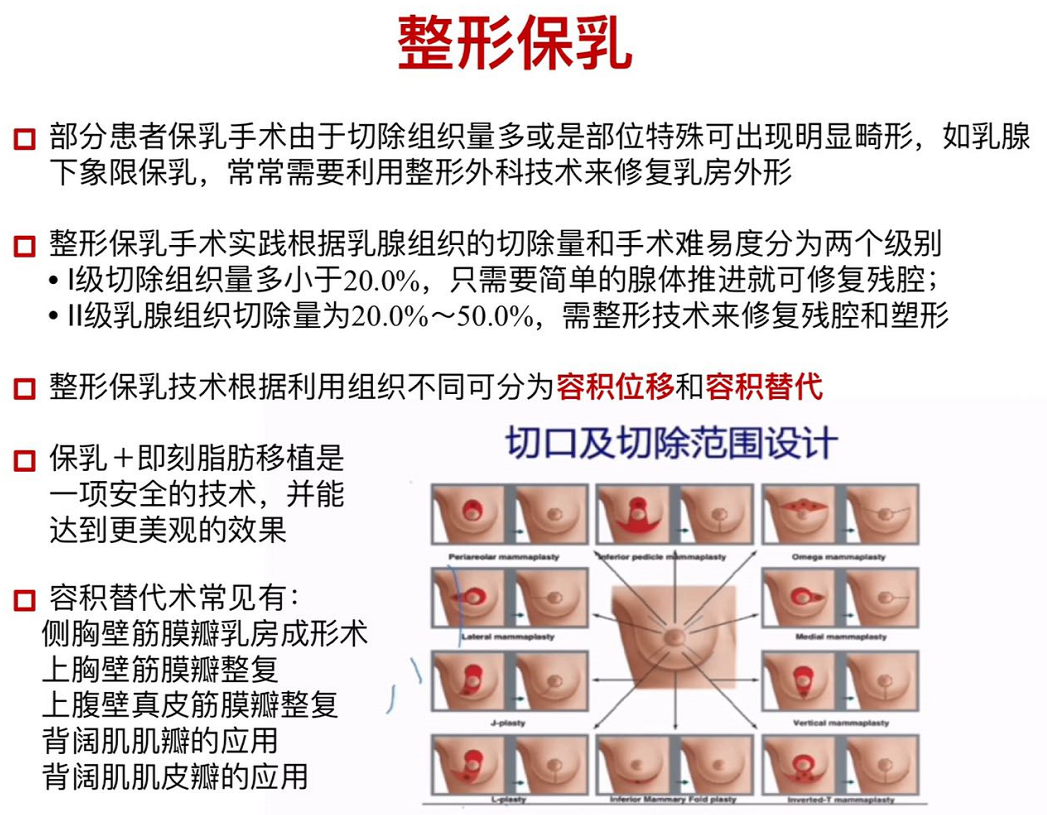
部分患者保乳?手术由于切除组织量多或是部位特殊可出现明显畸形,如乳腺下象限保乳,常常需要利?整形外科技术来修复乳房外形。整形保乳手术实践根据乳腺组织的切除量和手术难易度分为两个级别:Ⅰ级切除组织量多小于20.0%,只需要简单的腺体推进就可修复残腔;Ⅱ级乳腺组织切除量为20.0%~50.0%,需整形技术来修复残腔和塑形,整形保乳技术根据利用组织不同可分为容积位移和容积替代。容积替代术常见有侧胸壁筋膜瓣乳房成形术、上胸壁筋膜瓣整复、上腹壁真?皮筋膜瓣整复、背阔肌肌瓣的应用、背阔肌肌?皮瓣的应用。
保乳+即刻脂肪移植是一项安全的技术,并能达到更美观的效果。
中国指南未提及年龄因素,年轻需求更?。研究显示,年龄≤35岁患者的保乳局部复发是≥35岁患者的2-3倍;但20年随访,年轻患者保乳治疗和全乳切除的总生存和远处转移均无显著差异,能否选择保乳和分期有关,和年龄无关(年轻致密,术前充分评估,MRI),对于>65岁、T<2cm、HR+、内分泌治疗的部分病人保乳后可豁免放疗。
2016年一项来自Medicine Baretta的荟萃分析(n=105220)显示,与非BRAC突变者相?,BRAC突变者的总生存更差。2018年一项发表于Lancet Oncol的前瞻性随机对照研究(n=2733) 显示,≤40岁年轻乳腺癌患者携带BRCA基因突变与未携带突变基因者两组生存率相似。2019年发表于Int J Cancer的一项国内研究(n=2769)显示,与未携带相比,BRCA1突变基因携带者的无病生存率显著较低,OS无统计学差异。目前最新研究显示BRCA突变患者预后并不差,当然需更多研究证实。
有些研究报告胚系CHEK2 1100delC突变乳腺癌结果较差,美国NCCN指南将基因检测ATM纯合突变作为保乳禁忌症,而我国指南未列入。对于BRCA突变,2014年发表于Breast Cancer Res Treat的一项Meta分析纳入了10项关于BRCAm乳腺癌保乳手术安全性的研究,经过≥7年随访显示,BRCAm患者同侧复发风险更高。2018年的荷兰多中心队列研究中,接受保乳患者(n=1510)中,BRCA1m携带者(n=55)的10年累计局部复发率与非突变者无明显差异:(7.3% vs 7.9%),而BRCA2m携带者(n=21)的10年累计局部复发率高于与非突变患者(19.7% vs 7.9%)。
同样,2018年的荷兰多中心队列研究中,分析了6081例<50岁乳腺癌患者,结果显示BRCAm患者接受保乳或全切的OS无明显差异。2019年发表于Breast Cancer Res Treat的一项保乳手术(n=1947)研究中,103例BRCA基因突变病人的同侧复发事件与非突变病人差异无统计学意义(P=0.16),但新发肿瘤差异有统计学意义(P<0.01)。所以首先必须明确是“真实复发”又或是“新发肿瘤”,上海复旦肿瘤医院发布的最新数据,计501例患者,随访时间61-70个月,BRCA突变者保乳不增加复发风险,也不影响生存。
2020年ASCO/ASRO/SSO发布的关于遗传性乳腺癌的治疗指南,指出BRCA胚系突变状态不作为实施保乳的排出性因素。NCCN指南及2019年CBCS中国乳腺癌诊治指南与规范也做了类似推荐,提出BRCA突变是保乳治疗的局部复发的相关因素,推荐BRCA1/2携带者在风险评估和会诊后考虑额外的降低风险策略,应在术前进行多学科会诊,应讨论对侧和原发部位复发的风险。

手术治疗仍然是非转移性乳腺癌患者的重要治疗手段,在乳腺癌外科治疗的“减法时代”背景下,保乳治疗仍然是早期乳腺癌患者实现治愈,并提高生活质量的选择。随着乳腺癌的诊治技术发展,以及更加深入的分子生物学研究,乳腺癌外科治疗也将进入“精准治疗”的发展道路。包括保乳手术在内的乳腺癌外科治疗,也应逐渐实现个体化、精准化。
福建省立医院肿瘤外科主任医师
福建省立医院肿瘤外科行政副主任
中国抗癌协会乳腺癌专业委员会委员
CSCO乳腺癌专家委员会委员
中国医师协会肿瘤医师分会乳腺癌学组委员
海峡两岸医药卫生交流协会肿瘤防治专家委员会常务委员





 京公网安备 11010502033352号
京公网安备 11010502033352号