I-SPY2研究(Investigation of Serial Study to Predict Your Therapeutic Response through Imaging and Molecular Analysis 2)是基于影像和分子分析预测治疗效果的系列研究[1],针对乳腺癌新辅助治疗,通过适应性设计方案,最小化评估临床试验新药所需例数和时间,以提高试验效率,即根据试验中已累积的信息和数据,允许动态调整试验规则和/或统计方案,确保试验有效、科学且完整进行的同时,加速试验进展并提升试验效率。相较于传统的研究设计方案,I-SPY2研究的方案同样符合临床伦理要求,并且具有实施灵活、缩短研发时间、节约成本等多项优点,帮助研究者在有限的条件之下,快速获取研究数据。因此,I-SPY2研究受到了新药研发领域的极高关注,截至2021年4月最近一次更新,该平台已经设计了包括标准治疗方案在内的25个治疗方案,计划纳入4000例患者进行相关研究(NCT01042379) [2]。
基于I-SPY2的适应性设计方案,多个研究已经汇报了其数据结果:2016年NEJM(新英格兰医学杂志)既已发表了一项对于HER2+/HR-乳腺癌患者接受奈拉替尼+化疗对比标准化疗方案进行新辅助治疗研究的效果评估[3],2020年AACR报告了度伐利尤单抗+奥拉帕利与化疗联合作为新辅助治疗方案的研究结果[4],均为I-SPY2研究平台上的科研成果。
今年ASCO上再次公布了新的I-SPY2研究结果(摘要号508):采用瘤内注射SD-101+帕博利珠单抗联合化疗方案,对Ⅱ/Ⅲ期高危HER2-乳腺癌患者进行治疗效果和安全性的评估[5]。SD-101是一种类CpG-C寡脱氧核苷酸,可以刺激Toll样受体9(TLR9),通过TLR9途径进一步刺激固有免疫系统,刺激IFN-α和白细胞介素(IL)-12的产生、浆细胞样树突细胞的功能成熟以及细胞毒性抗体的产生,增强对肿瘤的获得性免疫反应(图1)。2018年在一项晚期黑色素瘤的Ⅰb期研究中显示出了SD-101+帕博利珠单抗方案可以在肿瘤部位诱导免疫激活,与PD-1阻断剂相结合可增加临床疗效,并且具有良好的耐受性和较小的药物毒性[6]。
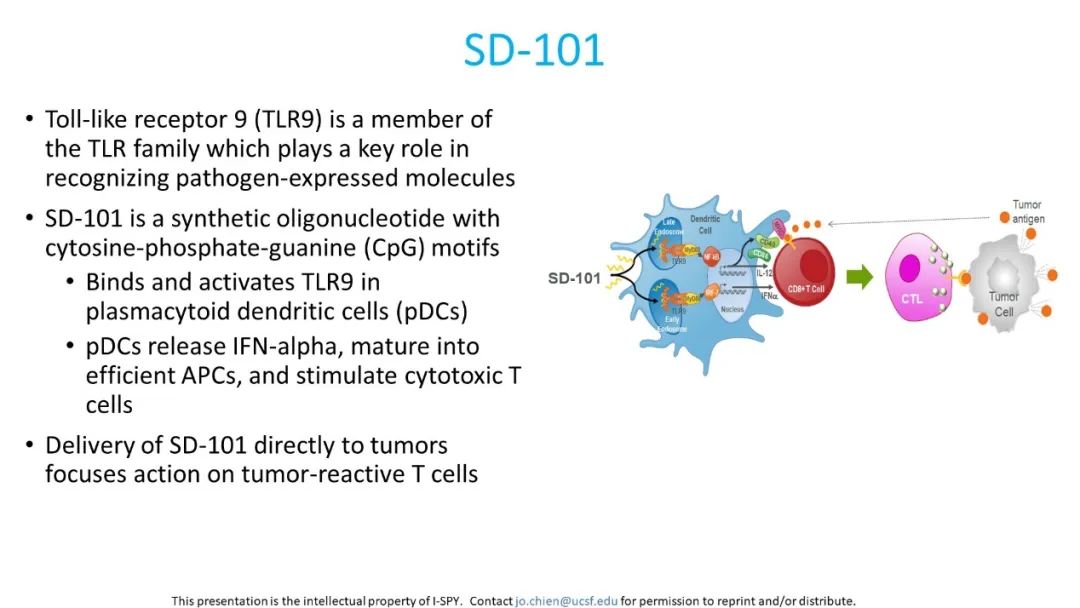
图1. SD-101作用机制
评估肿瘤内(IT)SD-101和帕博利珠单抗(Pb)联合紫杉醇(P)序贯AC治疗高危HER2阴性(HER2-)Ⅱ/Ⅲ期乳腺癌的效果:来自I-SPY2研究的结果。
研究人群纳入:肿瘤≥2.5cm,Ⅱ期或Ⅲ期,或者T4任意N、M0,包括临床或病理性炎性乳癌或锁骨上淋巴结转移为唯一转移部位的局部晚期HER2-女性患者,若HR+则MammaPrint评估需为高危,并且符合其他I-SPY2研究纳入排除标准(NCT01042379)[2],研究设计如图2所示。当研究组达到在预设人群(HER2-,HR+/HER2-和HR-/HER2-)中符合研究目标阈值(300例患者Ⅲ期新辅助试验中成功率>85%)时结束试验,主要研究结果为pCR(ypT0/is和ypN0)。

图2:I-SPY2 研究设计
该研究有75例患者被分配到SD-101+Pb组,329例历史病例组成对照组。由于研究组纳入患者人数到达最大值而研究已中止。两组患者的基线特征未见显著差异,SD-101+Pb组中HR+和HR-患者占比分别为61%和39%。所有HER2-患者中,SD-101+Pb组的估计pCR率(Estimated pCR rate)为34.1%高于对照组的19.9%,HR-和HR+人群的估计pCR率为43.7%和25.9%(图3)。但是,在这三组人群中预测Ⅲ期成功率均低于85%的目标阈值,HER2-人群预测成功率仅为71.7%。

图3.不同分子特征人群的主要研究结果
通过SD-101+Pb的治疗,HR+/HER2-患者中残留肿瘤负荷=0(RCB0)/pCR和RBC1出现了较明显的增加,RCB0和RCB1为49%,对照组为28%(图4)。

图4. SD-101+Pb在不同分子亚型患者RCB评估情况
在安全性评估方面,SD-101+Pb组最常见的不良反应为发热(58.7%)和中性粒细胞减少(41.3%),≥3级不良反应最常见的为中性粒细胞减少(28%)、发热性中性粒细胞减少(12%)、贫血(6.7%)和皮肤/软组织感染(6.7%)。SD-101+Pb的治疗组中有26例(35%)患者出现了免疫相关事件,最常见的免疫相关不良反应为肾上腺功能不全(12%),其他免疫相关不良反应详见图5。研究组中有8例(11.1%)患者出现了SD-101+Pb+紫杉醇早期停药,3例(5.4%)AC停药。
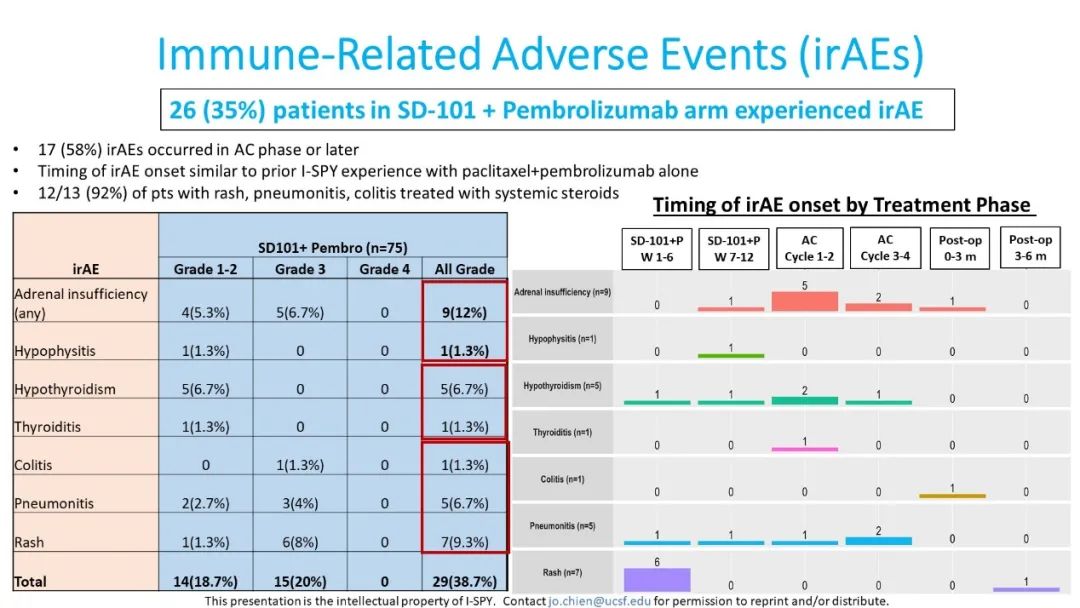
图5. SD-101+Pb组中免疫相关不良反应发生情况
研究证实了瘤内SD-101+Pb新辅助治疗方案相对于化疗方案,可以增加HER2-/HR+HER2-/HR-HER2-三类分子人群的估计pCR率,但并未达到I-SPY2研究预设的研究目标阈值。SD-101+Pb方案对比标准化疗,增加了更多的免疫相关不良反应。在Pb联合标准化疗的基础之上再联合SD-101并未进一步增加估计pCR率。SD-101+Pb方案获益人群的相关生物标志物探索研究正在进行。
SD-101作为免疫刺激药物联合免疫治疗能否够增加临床治疗效果,从本次I-SPY2研究结果中看并未达到理想的结果,SD-101联合免疫治疗提高pCR效果有限,并未达到推动大样本的Ⅲ期研究开展的预测目标。SD-101+Pb方案在各分子特征的高危乳腺癌患者中的估计pCR率虽然优于对照组,但这种优势并没有通过预测算法进一步转化提升成为扩大样本量后的成功概率。实际上,Keynote-522Ⅲ期研究评估Pb+化疗 vs. 化疗的新辅助方案正是基于既往在I-SPY2中所得到的Ⅱ期研究数据,预测HER2-人群中的Ⅲ期成功率超过了99%,从而使得Keynote-522研究得以迅速开展[6,7]。
当我们将SD-101+Pb和Pb对比标准化疗的I-SPY2 Ⅱ期新辅助治疗结果进行横向比较,不难发现既往的Pb结果优于本次SD-101+Pb的研究报告(图6),增加SD-101的免疫治疗方案并没有进一步提升患者的pCR率,也没有达到预设的Ⅲ期成功概率。除了SD-101以外,包括IL-2途径激动剂NKTR-214,叶酸受体α疫苗,新肿瘤抗原疫苗以及溶瘤病毒等多种免疫增强剂或免疫调节因子,也正在探索与免疫抑制剂联合治疗对于乳腺癌治疗的作用。乳腺癌免疫治疗是否可以通过免疫刺激药物或者其他增敏剂联合使用,进而提高免疫治疗效果,还有待更多临床试验的探索。

图6. 横向对比SD-101+Pb与Pb在I-SPY2 II期新辅助治疗研究结果*
*:上述研究并非同步实施的头对头研究,无法直接比较研究的结果,数据仅供参考
I-SPY2系列研究通过适应性研究设计优化了在研药物的临床试验实施。对于需要新辅助治疗的乳腺癌患者,精准医学/转化医学中获得的生物标志物可以进一步帮助临床研究去预先设计出潜在获益人群。正如I-SPY2将基因测序工具MammaPrint判断为高危风险作为新辅助治疗的指标之一,选择能够从化疗±免疫治疗中获益的潜在患者,进而探索需要新辅助治疗人群中的优化治疗方案。对于新药研发过程,I-SPY2将Ⅱ期临床研究结果作为依据,评估其Ⅲ期研究的成功可能性,这样的研究目标设定能够提升科研转化效率,加速科研成果的产出,值得临床科研工作者借鉴。
1、https://www.ispytrials.org/i-spy-platform/i-spy22、https://clinicaltrials.gov/ct2/show/NCT010423793、Park JW, Liu MC, Yee D, et al.Adaptive Randomization of Neratinib in Early Breast Cancer.N Engl J Med375:11-22, 2016.4、Lajos Pusztai, Hyo S. Han, Christina Yau, et al. Evaluation of durvalumab in combination with olaparib and paclitaxel in high-risk HER2 negative stage II/III breast cancer: results from the I-SPY 2 TRIAL. 2020 AACR,Session VCTPL01,CT0115、J Clin Oncol 39, 2021 (suppl 15; abstr 508)6、Ribas, Antoni, et al. "SD-101 in combination with pembrolizumab in advanced melanoma: results of a phase Ib, multicenter study." Cancer discovery 8.10 (2018): 1250-1257.7、N Engl J Med 2020; 382:810-8218、Journal of Clinical Oncology 35, no. 15_suppl (May 20, 2017) 506-506.





 京公网安备 11010502033352号
京公网安备 11010502033352号